(Traducción del artículo “Neurological manifestations of Ehlers-Danlos syndrome(s): A review”. Castori M (1), Voermans NC (2). Iran J Neurol 2014; 13(2): 190-208. Traducido por Alejandra Guasp)
(1) Departamento de Genética Médica, Hospital San Camillo-Forlanini, Univerisad Sapienza de Roma y San Camillo – Forlanin, Roma, Italia
(2) Departemento de Neurología, Centro Médico Universisad Radboud, Nijmegen, Holanda
Resumen
El término “Síndrome de Ehlers-Danlos” (SED) agrupa a un número creciente de enfermedades hereditarias del tejido conectivo que se caracterizan principalmente por hiperlaxitud articular y sus complicaciones relacionadas, displasia dérmica y textura y reparación anormal de la piel, y un grado variable de disfunciones vasculares y en los órganos internos.
Aunque el sistema nervioso no se considera como un punto primario del defecto molecular subyacente, recientemente ha ido en aumento la atención sobre las manifestaciones neurológicas del SED, como el dolor músculo- esquelético, la fatiga, el dolor de cabeza, la debilidad muscular y las parestesias.
Se presenta una revisión detallada de los hallazgos neurológicos de estas enfermedades, orientado principalmente al neurólogo clínico. Las características están organizadas bajo varios subtítulos, que incluyen el dolor, la fatiga, el dolor de cabeza, el accidente cerebrovascular y las enfermedades cerebrovasculares, las anomalías en el cerebro y la columna, la epilepsia, los hallazgos musculares, las neuropatías y las características del desarrollo.
El cuadro que emerge define un amplio abanico de manifestaciones neurológicas, que son inesperadamente comunes y potencialmente incapacitantes. La evaluación y la correcta interpretación por parte del neurólogo clínico son cruciales para evitar investigaciones superfluas, terapias incorrectas y derivaciones inadecuadas.
Se ofrece un conjunto de herramientas básicas para el reconocimiento de los pacientes, para aumentar la conciencia entre los neurólogos sobre este grupo de enfermedades hereditarias subdiagnosticadas.
Introducción
Desde la primera descripción en la bibliografía médica (1,2), la definición del Síndrome de Ehlers-Danlos (SED) ha cambiado significativamente, y de hecho se refiere a un abanico en expansión de enfermedades hereditarias del tejido conectivo que comparten una tríada de (i) hiperlaxitud articular generalizada y complicaciones osteoarticulares relacionadas, (ii) displasia dérmica, extendiéndose desde cambios menores en la textura de la piel hasta fragilidad dérmica clínicamente relevante y cicatrización defectuosa y (iii) fragilidad vascular y en los órganos internos, que predispone a lesiones traumáticas y rupturas espontáneas, disecciones y prolapsos (Figura 1).
La nosología del SED refleja la heterogeneidad de las manifestaciones clínicas, y en la actualidad comprende seis formas o variantes principales (a saber, los tipos Clásico, Hiperlaxitud, Vascular, Cifoescoliosis, Artrocalasia y Dermatosparaxis) (Tabla 1), así como una lista creciente de subtipos aparentemente más raros (Tabla 2). Hasta el momento, la sospecha clínica de varias de las formas del SED puede confirmarse mediante investigaciones de laboratorio específicas, particularmente con las pruebas moleculares (4).
Figura 1. Ejemplos de manifestaciones cutáneas y articulares del Síndrome de Ehlers-Danlos (SED)
Cicatrices papiráceas en un hombre (A) y una mujer (B) adultos con SED Clásico. Diferentes grados de hiperextensibiliad de la piel (C,D). Facilidad para el desarrollo de moretones extensos, debido a la fragilidad capilar en un adulto (E) y un niño (F). Hiperlaxitud articular en los dedos (G). Genu recurvatum (H)
Tabla 1. Criterios de Villefranche para los seis subtipos principales de Síndrome de Ehlers-Danlos
Variante común
|
Herencia
|
Gen(es) causante(s)
|
Criterios mayores
|
Criterios menores
|
Clásico
|
AD
|
COL5A1, COL5A2
|
Hiperextensibilidad de la piel
Cicatrices atróficas amplias
Hiperlaxitud articular
|
Piel suave, aterciopelada
Pseudotumores moluscoides
Esferoides subcutáneos
Complicaciones de la hiperlaxitud articular
Hipotonía muscular
Retrasos motores
Facilidad para los moretones
Manifestaciones de la extensibilidad y fragilidad de los tejidos
Complicaciones quirúrgicas
Antecedentes familiares positivos
|
Hiperlaxitud
|
AD
|
Mayormente desconocido(s)
|
Piel hiperextensible y/o piel aterciopelada
Hiperlaxitud articular generalizada
|
Dislocaciones articulares recurrentes
Dolor articular/de extremidades crónico
Antecedentes familiares positivos
|
Vascular
|
AD
|
COL3A1
|
Piel fina, translúcida
Fragilidad o rupturas arteriales/intestinales/uterinas
Moretones extensos
Apariencia facial característica
Acrogeria
|
Hiperlaxitud en las articulaciones pequeñas
Rupturas de tendons y músculos
Pie equinovaro
Aparición temprana de venas varicosas
Fístulas carotídeo-cavernosas
Neumotórax/Neumohemotórax
Retracción gingival
Antecedentes familares positivos
Muerte súbita en un familiar cercano
|
Cifoescoliosis
|
AR
|
PLOD1
|
Hiperlaxitud articular generalizada
Hipotonía congénita
Escoliosis congénita y progresiva
Fragilidad de las escleras y rupture del globo ocular
|
Fragilidad tisular, que incluye cicatrices atróficas
Facilidad para el desarrollo de moretones
Rupturas arteriales
Hábito marfanoide
Microcórnea
Osteopenia/porosis
Antecedentes familiares positivos
|
Artrocalasia
|
AD
|
COL1A1,
COL1A2
|
Hiperlaxitud articular generalizada con subluxaciones recurrentes
Dislocación bilateral congénita de la cadera
|
Hiperextensibilidad de la piel
Fragilidad tisular, que incluye cicatrices atróficas
Facilidad para el desarrollo de moretones
Hipotonía
Cifoescoliosis
Osteopenia/porosis
|
Dermatosparaxis
|
AR
|
ADAMTS2
|
Fragilidad severa de la piel
Piel floja, redundante
|
Piel suave, de textura pastosa
Facilidad para el desarrollo de moretones
Ruptura prematura de membranas fetales
Hernias grandes (umbilical, inguinal)
|
AD: Autosómica dominante; AR: Autosómica recesiva; SED: Síndrome de Ehlers-Danlos.
No se especifican indicaciones claras para el uso de estos criterios para establecer una sospecha clínica firme de un tipo específico de SED. Sin embargo, generalmente se necesita la presencia de al menos 1 criterio mayor y 1 criterio menor para proceder a la confirmación molecular de los tipos de SED con una causa molecular conocida y prevalente. La presencia de al menos 2 criterios mayores es fuertemente indicadora de un diagnóstico definitivo de SED del tipo específico.
[Adaptado de Beighton et al. (3) ]
Tabla 2. Variantes raras del Síndrome de Ehlers-Danlos sin criterios diagnósticos clínicos disponibles en la actualidad
Variante rara
|
Herencia
|
Gen(es)
|
Asociación con deficiencia de 21 α-hydroxilasa
|
AR
|
TNXB, CYP21B
|
Asociación con síndrome de Gilles de la Tourette
|
AD
|
HDC
|
Asociación con parodontitis
|
AD
|
Unknown
|
Asociación con heterotopia periventricular
|
XLD
|
FLNA
|
Síndrome de córnea frágil tipo 1
|
AR
|
ZNF469
|
Síndrome de córnea frágil tipo 2
|
AR
|
PRDM5
|
Cardíaco-valvular
|
AR
|
COL1A2
|
Clásica con rupturas arteriales
|
AD
|
COL1A1
|
Solapamiento Síndrome de Ehlers-Danlos/osteogenesis imperfecta
|
AD
|
COL1A1, COL1A2
|
Forma similar al Síndrome de Ehlers-Danlos, debida a una deleción en 6q27
|
Esporádica/AD
|
No aplicable
|
Cifoescoliosis con miopatía y sordera
|
AR
|
FKBP14
|
Músculo-contractural, tipo 1
|
AR
|
CHST14
|
Músculo-contractural, tipo 2
|
AR
|
DSE
|
Solapamiento de fenotipo debido a haploinsuficiencia en COL3A1/COL5A2/MSTN
|
AD
|
COL3A1, COL5A2, MSTN (deleción)
|
Progeroide
|
AR
|
B4GALT7
|
Espóndilo-queiro-displásica
|
AR
|
SLC39A13
|
Deficiente en Tenascina X
|
AR, AD (?)
|
TNXB
|
AD: Autosómica dominante; AR: Autosómica recesiva; XLD: ligada a X dominante; SED: Síndrome de Ehlers-Danlos
Tabla 3. Criterios de Brighton para el Síndrome de Hiperlaxitud Articular
Criterios Mayores
|
Puntaje de Beighton ≥ 4/9
|
Artralgias durante > 3 meses en > 4 articulaciones
|
Criterios Menores
|
Puntaje de Beighton 1-3
|
Artralgias en 1-3 articulaciones
|
Antecedentes de dislocaciones
|
Lesiones de tejidos blandos > 3
|
Hábito marfanoide
|
Estrías, hiperextensibilidad de la piel o mala cicatrización
|
Fisura palpebral antimongoloide, laxitud palpebral, miopía
|
Antecedentes de venas varicosas, hernias, prolapsos viscerales
|
Fuente: Grahame et al. y modificaciones subsiguientes (ver, por ejemplo, Tinkle et al.)
Sin embargo, el SED tipo Hiperlaxitud (SED-H), que es una de las variantes más comunes, todavía tiene diagnóstico clínico, basado en características sutiles y probablemente inespecíficas, y muestra un solapamiento casi completo con el Síndrome de Hiperlaxitud Articular (SHA) (Tabla 3), una enfermedad reumatológica hereditaria definida por los Criterios de Brighton (5-7). La pregunta sobre si el SED-H y el SHA también son idénticos a nivel molecular aún es tema de debate (8). Esto implica que mientras que un grupo de pacientes recibe una confirmación de laboratorio rigurosa para las formas más raras, pero bien definidas del SED, todos los demás, que caen dentro del espectro borroso del SED-H/SHA, a menudo escapan de la atención de los médicos y a veces desarrollan complicaciones incapacitantes, aunque potencialmente evitables. En línea con esto, la frecuencia acumulada estimada del SED de 1 cada 5000 habitantes en la población general (9) probablemente sea una subestimación y la prevalencia real de las variantes individuales más comunes sea mucho mayor, como se ha propuesto recientemente para el SHA (10).
Los calambres musculares recurrentes fueron registrados en el SED por Beighton & Horan a fines de la década de 1960 (11). Luego de este primer artículo, que de hecho se enfocó en los aspectos ortopédicos del SED, muchos otros registros (revisados en las siguientes secciones) han destacado una participación probablemente importante del sistema nervioso en esta enfermedad. Sin embargo, la mayoría de los trabajos describe pacientes individuales o pequeñas series de casos, lo que contribuye a la falta de conciencia sobre las manifestaciones neurológicas en el SED.
En 2009, Voermans et al., por primera vez, ejemplificaron sus hallazgos en 40 pacientes con diferentes tipos de SED y demostraron una participación neuromuscular, sutil pero importante, en esta enfermedad (12).
Una revisión reciente, dirigida principalmente a los neurólogos pediátricos, enfatiza una participación neurológica heterogénea y potencialmente incapacitante en el SED, con un amplio rango de anomalías en el sistema nervioso, aparentemente de baja frecuencia, pero posiblemente específicas de los subtipos de la enfermedad (13).
Además, al menos en el SHA/SED-H, el dolor músculo esquelético, la fatiga y la jaqueca representan los elementos que más contribuyen a la derivación de los pacientes por parte de los médicos clínicos y al deterioro en la calidad de vida (14).
Ahora bien, es lo suficientemente claro que la comprensión del alcance de la participación del sistema nervioso y de sus procesos patológicos subyacentes representan un punto nodal para una mejor evaluación de los pacientes con SED y para el desarrollo de estrategias más eficientes de rehabilitación y prevención.
En este artículo revisamos la bibliografía pertinente que registra un aparente aumento en la tasa de características neurológicas en el SED. Nuestro objetivo fue ofrecerles a los neurólogos clínicos una referencia práctica al considerar esta enfermedad en individuos con una patología neurológica aparentemente primaria, así como a quienes toman parte de los equipos multidisciplinarios involucrados en el tratamiento de los pacientes con SED.
Métodos de búsqueda
Este trabajo se planeó como una revisión narrada, para resumir la evidencia actual de la participación del sistema nervioso en el SED. Se realizó una búsqueda en PubMed combinando los términos “SED” O “Síndrome de Hiperlaxitud”, con los siguientes términos: sistema nervioso central, cerebro, médula, columna, accidente cerebrovascular, epilepsia, músculo, miopatía, nervio(s) periférico(s), polineuropatía, sistema nervioso (periférico), y nervio. Se seleccionaron artículos cuando reportaban pacientes con SED/SHA con manifestaciones neurológicas. Además, en las listas de referencia de los artículos seleccionados, se buscaron reportes adicionales. Nuestros hallazgos se registran en los siguientes párrafos.
Dolor
El dolor ahora se acepta como una característica frecuente y potencialmente incapacitante de las diferentes formas del SED, especialmente del SED-H/SHA (14). Esto está testimoniado con la inclusión del dolor músculo esquelético como un punto mayor en los criterios de Brighton para el SHA (5) y como una característica menor en los criterios de Villefranche para determinados subtipos (3).
Por el contrario, en la bibliografía antigua, el dolor se reconocía como un hallazgo marginal, que generalmente se producía en forma aguda debido a (sub)luxaciones, rupturas espontáneas de vasos sanguíneos (15) y de órganos internos (16), o en forma recurrente en relación con las pápulas piezogénicas (17) o con complicaciones ginecológicas/obstétricas (18).
En 1994, Lumley et al. apuntaron por primera vez a un posible rol del dolor crónico en la calidad de vida de los pacientes con SED, al estudiar el funcionamiento psicosocial de 48 individuos con diferentes formas de SED (19).
Además, la evidencia reiterada de resistencia a los anestésicos locales, tanto en el SED-H (20) como en el SHA (21) sugiere, desde fines del siglo pasado, un efecto más complejo en la percepción y en los procesos de modulación del dolor en el SED.
La conciencia científica de la importancia clínica del dolor en el SED aumentó en 2010, cuando Voermans et al. publicaron los resultados de su estudio en 273 pacientes con varias formas de SED (principalmente tipos Clásico, Hiperlaxitud y Vascular) y encontraron que el dolor era frecuente, severo y se asociaba a un deterioro funcional.
Es interesante notar que el dolor pareció ser más severo en el SED-H que en los tipos Clásico y Vascular, y que la severidad del dolor se correlacionó con la hiperlaxitud, las dislocaciones y las cirugías previas (22). Esta observación preliminar impulsó al mismo equipo de investigación a establecer que el dolor y la fatiga posiblemente son determinantes importantes de la discapacidad en el SED-H (23).
Desde una perspectiva clínica, el dolor crónico recurrente es la presentación más compleja de dolor en el SHA/SED-H, lo que está reflejado en los criterios diagnósticos pertinentes (3,5).
Las manifestaciones adicionales del dolor músculo esquelético en el SED-H/SHA, y quizás en otros subtipos de SED, incluye los calambres musculares (11), la fibromialgia (24, 25) y las neuropatías por compresión/periféricas (26,27). El dolor no se limita al sistema músculo esquelético, y a menudo presenta participación visceral, en la forma de varios síntomas gastrointestinales crónicos y recurrentes (28), así como con la dispareunia, la vulvodinia y la dismenorrea (29, 30). La jaqueca también es común en el SED (31) y se discute en una sección aparte.
El estudio de la historia natural del SED-H/SHA nos dice que el dolor es una característica cambiante en el SED y que sus consecuencias funcionales están influenciadas por las estrategias de adaptación que varias estructuras de los individuos afectados desarrollan, en conjunto, para afrontar la percepción del dolor reiterado (14). Concordando con y siguiendo las postulaciones previas (14), un estudio reciente de Rombaut et al. demuestra la presencia de hiperalgesia en el SED-H (32). Este hallazgo puede representar una prueba preliminar de la acción de los procesos de sensibilización central en aquellos pacientes con SED que desarrollan las discapacidades más severas asociadas al dolor.
Fatiga
Aunque fue mayormente ignorada en el pasado, la fatiga severa ahora se considera una característica que acompaña al SED, particularmente al SED-H, y se registra hasta en el 84% de los pacientes (33). Otros grupos de investigación han encontrado resultados similares (34,35). Más específicamente, la frecuencia (y quizás la severidad) de la fatiga está influenciada por la edad, con una tasa que va desde 28% en la primera década de vida, hasta un 90% en los adultos de más de 40 años (35).
En el SHA/SED-H, el impacto de la fatiga en la vida diaria a menudo es igual o mayormente dramático que el impacto del dolor (33), un hecho que subraya la importancia de la fatiga, tanto en la evaluación como en la planificación del tratamiento de estos pacientes. De acuerdo con Fukuda et al. (36) la presentación compleja de la fatiga, que recuerda el síndrome de fatiga crónica, se encuentra en la mayoría de los adultos con SHA/SED-H (37).
Se han investigado algunos posibles factores que contribuyen a la discapacidad relacionada con la fatiga en el SED; éstos incluyen los trastornos del sueño, los problemas de concentración, el funcionamiento psicosocial, la autoeficacia relacionada con la fatiga y la severidad del dolor (33). Unos pocos estudios experimentales demuestran que la fatiga se asocia con la debilidad muscular (38,39), empeora con el ejercicio (40) y afecta el patrón de marcha (41). Recientemente, la Disautonomía fue reconocida como uno de los factores patogénicos más relevantes que influencian la aparición y la evolución de la fatiga. Esta característica, mayormente estudiada en el SED-H/SHA, a menudo se presenta con síndrome de taquicardia ortostática (42) y/o con intolerancia ortostática (42), y parece relacionarse con un aumento de la actividad simpática con el descanso y una reducción en la reactividad simpática ante los estímulos (43).
Jaquecas y dolor de cabeza
En 1996, Spranger et al. registraron por primera vez jaqueca, drop attacks y anomalías en la sustancia blanca en una mujer de 37 años con SED y con parodontitis (44). Un año después, un estudio en 59 individuos con diferentes formas de SED (13 pacientes con tipo Clásico, 28 con SED-H, 1 con SHA, 7 con tipo Vascular y 2 sin clasificación del tipo) mostró que el dolor de cuello y la jaqueca estaban presentes en el 30-40% de los casos (31). Una serie de casos posteriores registró a 40 pacientes con SED que presentaban varias formas de jaqueca, incluyendo (i) migrañas con aura (ii) migrañas sin aura (iii) jaquecas tensionales (iv) una combinación de jaquecas tensionales y migrañas, y (v) jaquecas post traumáticas (45).
Trabajos adicionales, en series de caso pequeñas, confirman la elevada prevalencia del dolor de cabeza en el SED-H/SHA (34, 36). Más específicamente, Bendik et al. mostraron que la migraña (con o sin aura) era aproximadamente tres veces más común en un grupo de 28 mujeres con SHA/SED-H, comparado con 32 controles, con una frecuencia acumulada de 75% (3/4) (47). En una mujer de 36 años con jaqueca ortostática e hipertensión idiopática intracraneal, se alcanzó el diagnóstico de SHA dos años después de la aparición del dolor (48). Esta paciente mostró un aumento en los niveles plasmáticos de IGF-1 y los autores especularon sobre la posible relación patogénica.
El dolor de cabeza en el SED no se limita a la jaqueca. En una cohorte de 31 pacientes (incluyendo 16 con SED-H, 9 con SED Clásico y 6 con SED Vascular), De Coster et al. demostraron disfunción en la articulación temporomandibular en el 100% de los casos, dolor miofascial unilateral (dolor de cabeza en la sien) en el 83%, y dolor unilateral y bilateral en la articulación temporomandibular en 28% y 51% de los pacientes respectivamente (49).
Mientras que muchos pacientes con SED pueden desarrollar dolor de cabeza crónico o recurrente, los individuos con tipos de SED con fragilidad vascular (es decir, el SED Vascular, el SED Clásico con rupturas arteriales y el SED Cifoescoliosis) tienen un aumento del riesgo de jaqueca súbita, secundaria a enfermedad cerebrovascular aguda. En particular, el dolor de cabeza agudo puede producirse junto con la oftalmoplejia o el tinnitus, debidos a fístulas carotídeo-cavernosas espontáneas y directas en estos tipos de SED (50, 51). Observaciones adicionales señalan posibles asociaciones entre la hiperlaxitud localizada o generalizada y conjuntos específicos de dolores de cabeza primarios y secundarios, incluido el dolor de cabeza diario persistente (52) y la jaqueca atribuida a fugas espontáneas (idiopáticas) de líquido cefalorraquídeo (53,54). La hiperlaxitud/disfunción en la columna cervical también se ha considerado anecdóticamente como un factor que predispone al dolor de cabeza cervicogénico (55,56) y al síndrome de cuello-lengua (57-59). Concordando con esto, Di Palma & Cronin registraron una mujer de 27 años con SED Clásico con un dolor de cabeza pulsante de larga duración asociado con dislocación de C2 (60).
Accidente cerebrovascular y enfermedad cerebrovascularLa mayoría de los reportes sobre accidente cerebrovascular y enfermedad cerebrovascular en el SED se relacionan con el SED Vascular, e incluyen aneurismas intracraneales, hemorragias subaracnoideas, disecciones arteriales espontáneas y fístulas del seno cavernoso. En pacientes con SED Clásico, ocasionalmente se producen aneurismas, mientras que otras anormalidades vasculares son raras. De hecho, la presencia de accidente cerebrovascular en pacientes con características cutáneas del SED Clásico debería dirigir hacia la investigación molecular para la variante clásica con rupturas arteriales debida a mutaciones en COL1A1.
En 1990, Schievink et al. registraron dos pacientes con SED Vascular, uno con disección espontánea de la arteria carótida interna y uno con una hemorragia subaracnoidea y disecciones aórticas múltiples (61). Ambos pacientes tenían deficiencias en el colágeno tipo III, analizado en cultivos de fibroblastos.
Luego, el mismo autor registró el caso de una mujer de 20 años con SED Vascular, que presentó una fístula carotídeo-cavernosa espontánea y una disección en la arteria cervical (62). También se analizaron las características clínicas de los 16 casos publicados anteriormente de fístulas carotídeo-cavernosas espontáneas (62). Dado que la deficiencia en el colágeno tipo III tiene un rol en la patogénesis de los aneurismas saculares intracraneales, es probable que esté involucrado en la patogénesis de las fístulas carotídeo-cavernosas y de las disecciones de las arterias cervicales (61).
En 1995, North et al. estudiaron las complicaciones cerebrovasculares en una cohorte de 202 pacientes con SED vascular (63). 19 pacientes tuvieron complicaciones cerebrovasculares, incluyendo aneurismas intracraneales con hemorragia secundaria, fístulas carotideo-cavernosas espontáneas y disecciones en las arterias cervicales.
Los aneurismas típicamente se desarrollan en el seno cavernoso, o en sitios directamente adyacentes a él; también se han registrado aneurismas carotídeos bilaterales y recurrentes (64-68).
Una fístula carotideo-cavernosa se puede desarrollar luego de un trauma menor en la cabeza, pero principalmente se produce de manera espontánea, en muchos casos luego de una ruptura de un aneurisma de la arteria carótida interna dentro del seno cavernoso (62). Estas fístulas carotideo-cavernosas a menudo se presentan con exoftalmos, quemosis, dolor, oftalmoplejia y soplos, que son el resultado del elevado flujo sanguíneo, que permite que la sangre arterial presurizada se conecte directamente con el seno cavernoso, dando como resultado hipertensión venosa e inversión del drenaje venoso (69).
Aunque es poco frecuente, el SED Vascular es una causa potencial de accidente cerebrovascular en adultos jóvenes (70-72). En los casos típicos, la enfermedad es fácilmente identificable mediante la evaluación clínica y las pruebas moleculares específicas. Sin embargo, la variabilidad fenotípica del SED Vascular podría llevar a subdiagnosticarlo, especialmente en el escenario de emergencias (71). Por ello, debe enfatizarse la revisión completa de la historia clínica y el examen físico, y la revisión completa de antecedentes familiares, ya que a menudo solo la combinación de todos estos datos aumenta la sospecha del SED Vascular. Esto es crucial, ya que el diagnóstico tiene importantes implicancias para el tratamiento agudo y a largo plazo, y potencialmente, para otros miembros de la familia (71).
En el SED Vascular, el abordaje tradicional ha sido tratar esas complicaciones de manera conservadora, a menos que sean potencialmente mortales. Informes recientes desafían este paradigma del tratamiento (73). En un estudio aleatorio, el tratamiento con el beta bloqueante Celiprolol mostró asociarse con una reducción en 3 veces de las rupturas arteriales en el SED Vascular (74). Los abordajes nuevos utilizando la terapia endovascular con embolización con stent han demostrado buenos resultados en el tratamiento de rupturas de pseudoaneurismas y de fístulas caotídeo-cavernosas (69,73). Sin embargo, frecuentemente se registran complicaciones. La terapia con anticoagulantes puede dar como resultado un aumento en los moretones o las hemorragias y debería utilizarse con precaución (63,75). Dado que las angiografías convencionales pueden exacerbar complicaciones severas, las angiografías por resonancia magnética no invasivas son la opción para realizar investigaciones.
Trabajos adicionales, en series de caso pequeñas, confirman la elevada prevalencia del dolor de cabeza en el SED-H/SHA (34, 36). Más específicamente, Bendik et al. mostraron que la migraña (con o sin aura) era aproximadamente tres veces más común en un grupo de 28 mujeres con SHA/SED-H, comparado con 32 controles, con una frecuencia acumulada de 75% (3/4) (47). En una mujer de 36 años con jaqueca ortostática e hipertensión idiopática intracraneal, se alcanzó el diagnóstico de SHA dos años después de la aparición del dolor (48). Esta paciente mostró un aumento en los niveles plasmáticos de IGF-1 y los autores especularon sobre la posible relación patogénica.
El dolor de cabeza en el SED no se limita a la jaqueca. En una cohorte de 31 pacientes (incluyendo 16 con SED-H, 9 con SED Clásico y 6 con SED Vascular), De Coster et al. demostraron disfunción en la articulación temporomandibular en el 100% de los casos, dolor miofascial unilateral (dolor de cabeza en la sien) en el 83%, y dolor unilateral y bilateral en la articulación temporomandibular en 28% y 51% de los pacientes respectivamente (49).
Mientras que muchos pacientes con SED pueden desarrollar dolor de cabeza crónico o recurrente, los individuos con tipos de SED con fragilidad vascular (es decir, el SED Vascular, el SED Clásico con rupturas arteriales y el SED Cifoescoliosis) tienen un aumento del riesgo de jaqueca súbita, secundaria a enfermedad cerebrovascular aguda. En particular, el dolor de cabeza agudo puede producirse junto con la oftalmoplejia o el tinnitus, debidos a fístulas carotídeo-cavernosas espontáneas y directas en estos tipos de SED (50, 51). Observaciones adicionales señalan posibles asociaciones entre la hiperlaxitud localizada o generalizada y conjuntos específicos de dolores de cabeza primarios y secundarios, incluido el dolor de cabeza diario persistente (52) y la jaqueca atribuida a fugas espontáneas (idiopáticas) de líquido cefalorraquídeo (53,54). La hiperlaxitud/disfunción en la columna cervical también se ha considerado anecdóticamente como un factor que predispone al dolor de cabeza cervicogénico (55,56) y al síndrome de cuello-lengua (57-59). Concordando con esto, Di Palma & Cronin registraron una mujer de 27 años con SED Clásico con un dolor de cabeza pulsante de larga duración asociado con dislocación de C2 (60).
Accidente cerebrovascular y enfermedad cerebrovascularLa mayoría de los reportes sobre accidente cerebrovascular y enfermedad cerebrovascular en el SED se relacionan con el SED Vascular, e incluyen aneurismas intracraneales, hemorragias subaracnoideas, disecciones arteriales espontáneas y fístulas del seno cavernoso. En pacientes con SED Clásico, ocasionalmente se producen aneurismas, mientras que otras anormalidades vasculares son raras. De hecho, la presencia de accidente cerebrovascular en pacientes con características cutáneas del SED Clásico debería dirigir hacia la investigación molecular para la variante clásica con rupturas arteriales debida a mutaciones en COL1A1.
En 1990, Schievink et al. registraron dos pacientes con SED Vascular, uno con disección espontánea de la arteria carótida interna y uno con una hemorragia subaracnoidea y disecciones aórticas múltiples (61). Ambos pacientes tenían deficiencias en el colágeno tipo III, analizado en cultivos de fibroblastos.
Luego, el mismo autor registró el caso de una mujer de 20 años con SED Vascular, que presentó una fístula carotídeo-cavernosa espontánea y una disección en la arteria cervical (62). También se analizaron las características clínicas de los 16 casos publicados anteriormente de fístulas carotídeo-cavernosas espontáneas (62). Dado que la deficiencia en el colágeno tipo III tiene un rol en la patogénesis de los aneurismas saculares intracraneales, es probable que esté involucrado en la patogénesis de las fístulas carotídeo-cavernosas y de las disecciones de las arterias cervicales (61).
En 1995, North et al. estudiaron las complicaciones cerebrovasculares en una cohorte de 202 pacientes con SED vascular (63). 19 pacientes tuvieron complicaciones cerebrovasculares, incluyendo aneurismas intracraneales con hemorragia secundaria, fístulas carotideo-cavernosas espontáneas y disecciones en las arterias cervicales.
Los aneurismas típicamente se desarrollan en el seno cavernoso, o en sitios directamente adyacentes a él; también se han registrado aneurismas carotídeos bilaterales y recurrentes (64-68).
Una fístula carotideo-cavernosa se puede desarrollar luego de un trauma menor en la cabeza, pero principalmente se produce de manera espontánea, en muchos casos luego de una ruptura de un aneurisma de la arteria carótida interna dentro del seno cavernoso (62). Estas fístulas carotideo-cavernosas a menudo se presentan con exoftalmos, quemosis, dolor, oftalmoplejia y soplos, que son el resultado del elevado flujo sanguíneo, que permite que la sangre arterial presurizada se conecte directamente con el seno cavernoso, dando como resultado hipertensión venosa e inversión del drenaje venoso (69).
Aunque es poco frecuente, el SED Vascular es una causa potencial de accidente cerebrovascular en adultos jóvenes (70-72). En los casos típicos, la enfermedad es fácilmente identificable mediante la evaluación clínica y las pruebas moleculares específicas. Sin embargo, la variabilidad fenotípica del SED Vascular podría llevar a subdiagnosticarlo, especialmente en el escenario de emergencias (71). Por ello, debe enfatizarse la revisión completa de la historia clínica y el examen físico, y la revisión completa de antecedentes familiares, ya que a menudo solo la combinación de todos estos datos aumenta la sospecha del SED Vascular. Esto es crucial, ya que el diagnóstico tiene importantes implicancias para el tratamiento agudo y a largo plazo, y potencialmente, para otros miembros de la familia (71).
En el SED Vascular, el abordaje tradicional ha sido tratar esas complicaciones de manera conservadora, a menos que sean potencialmente mortales. Informes recientes desafían este paradigma del tratamiento (73). En un estudio aleatorio, el tratamiento con el beta bloqueante Celiprolol mostró asociarse con una reducción en 3 veces de las rupturas arteriales en el SED Vascular (74). Los abordajes nuevos utilizando la terapia endovascular con embolización con stent han demostrado buenos resultados en el tratamiento de rupturas de pseudoaneurismas y de fístulas caotídeo-cavernosas (69,73). Sin embargo, frecuentemente se registran complicaciones. La terapia con anticoagulantes puede dar como resultado un aumento en los moretones o las hemorragias y debería utilizarse con precaución (63,75). Dado que las angiografías convencionales pueden exacerbar complicaciones severas, las angiografías por resonancia magnética no invasivas son la opción para realizar investigaciones.
Anomalías estructurales en el cerebro y la columna
La resonancia magnética (RMI) del cerebro en el SED generalmente no presenta nada fuera de lo común en cuanto a anomalías estructurales importantes. Por ello, con la excepción de las presentaciones agudas en las que se sospecha enfermedad cerebrovascular, dicha investigación generalmente no forma parte de la evaluación basal de los pacientes con SED. Sin embargo, la presencia de un caso claro de transmisión dominante ligada al cromosoma X, y/o la coexistencia de convulsiones, debería apuntar a la exclusión de la forma rara del SED con heterotopia periventricular (Figura 2), debida a menudo a mutaciones en FLNA (76, 77).
Figura 2. Heterotopia periventricular en una mujer de 37 años con características del Síndrome de Ehlers-Danlos tipo Clásico
Registros aislados asocian el SED con polimicrogiria (78), agenesia del cuerpo calloso (79), dilatación del 4to ventrículo, de la cisterna supracerebelosa y del ventrículo lateral, o agrandamiento desproporcionado del cuerno anterior del ventrículo lateral (80), pero no se ha confirmado la consistencia de estas asociaciones.
Por el contrario, la práctica clínica sugiere una alta tasa de hallazgos degenerativos, como la aparición generalizada temprana de espondilosis y de hernias de disco en las resonancias magnéticas de columna. Sin embargo, esta evidencia es anecdótica (81) y necesita confirmación sistemática. Las resonancias de columna también pueden mostrar quistes meníngeos, según se registró en una niña de 7 años con SED tipo Cifoescoliosis (82), en un adulto con SED Clásico (83) y con una baja frecuencia en el SHA/SED-H (84).
En el SED, los quistes meníngeos (o de Tarlov) aparentemente son raros y muy pocos o aislados. Una mujer de 40 años con quistes de Tarlov múltiples y bilaterales a lo largo de la columna entera, y originalmente definida como un ejemplo (no clasificado) de SED por Isono et al. (85) puede definirse major con el diagnóstico de síndrome del meningocele lateral (86), una forma aparentemente diferente de enfermedad hereditaria del tejido conectivo con participación tecal (87).
La importancia clínica de los quistes meníngeos todavía se desconoce en el SED, aunque podría inferirse la relación con la jaqueca ortostática, debida a fugas espontáneas de líquido cefalorraquídeo (88,89), de manera similar a lo que ocurre en el Síndrome de Marfan.
La concurrencia de malformación de Chiari (tipo I) es una característica adicional subregistrada en el SED, ya que a la fecha se ha observado solo en pacientes aislados (45,46). Sin embargo, en un artículo orientado a la cirugía en cientos de pacientes originalmente evaluados por malformación de Chiari sintomática, un subgrupo de ellos, que mostró una elevada tasa de recurrencia luego de la cirugía y múltiples características de una enfermedad del tejido conectivo subyacente, presentaba características neuroradiológicas, mínimas pero medibles, de inestabilidad occipitoatlantoaxial: deslizamiento posterior de los cóndilos occipitales y reducción del ángulo clivus-axis, del ángulo atlas-clivus y atlas-axis en posición erguida (90). Concordando con esto, un registro anterior describe a dos pacientes con SED vascular con subluxación atlantoaxial radiológicamente evidente (91). Por ello es relevante investigar la posible presencia de hernias en las amígdalas cerebrales y de inestabilidad occipitoatlantoaxial oculta durante la evaluación del paciente con dolor de cabeza occipital o postural/ortostático, y/o con síntomas neurológicos inexplicables, como parestesias y debilidad en los miembros superiores.
Epilepsia
Los mecanismos que explican la posible asociación entre el SED y las convulsiones probablemente son heterogéneos. En 1981, Cupo et al. registraron el caso de una mujer de 30 años con SED, que falleció debido a una fibrilación ventricular intratable, debido a infarto de miocardio. También tenía convulsiones, aneurismas en el seno de Valsalva y enfisema panacinar severo. Los hallazgos de la necropsia incluyeron heterotopia cerebral (92). Desde esta primera descripción, registros adicionales sugieren la existencia de una forma de SED distinta, con características cutáneas que asemejan las del SED Clásico, junto con heterotopia periventricular subependimaria (76). En la mayoría de los casos, esta presentación se transmite con un patrón dominante ligado a X y se asocia a una mutación en la filamina A (77,93).
Además, Jacome registró siete pacientes con SED, dos de ellos afectados por síndrome del cuerno occipital, que de hecho se ha retirado de la clasificación del SED, con epilepsia y varias complicaciones neurológicas concomitantes (94).
De los 5 individuos restantes, con diagnóstico más estricto de SED, los posibles determinantes para las convulsiones incluyeron la hipoplasia de la arteria basilar, la atrofia hemisférica, el angioma venoso parietal, hemorragias intracraneales previas y convulsiones previas.
Registros adicionales de SED con convulsiones incluyen un hombre de 29 años con SED sin determinación de tipo y polimicrogiria bilateral frontocentral y frontoposterior, con hipoplasia del vermis cerebeloso, una mujer de 20 años con SED-H y polimicrogiria perisilviana bilateral (78) y un varón de 16 años con SED Clásico y agenesia del cuerpo calloso (79). Estos registros sugieren un probable aumento en la tasa de epilepsia en el SED. Aunque en muchos casos pueden identificarse anomalías estructurales en el cerebro (particularmente las heterotopias periventriculares), los mecanismos que conectan las convulsiones con un defecto hereditario del tejido conectivo continúan escasamente estudiados.
Hallazgos musculares
El SED se asocia con varias características neuromusculares; y viceversa, varias miopatías congénitas muestran hiperlaxitud articular, con un menor alcance de cambios en la piel (95). La conciencia de este solapamiento clínico entre las enfermedades hereditarias del tejido conectivo y ciertas miopatías congénitas podría ayudar al reconocimiento de estas enfermedades raras (96). Los reportes iniciales de Beighton ya incluían una alta prevalencia de mialgias y de calambres musculares nocturnos en las pantorrillas, especialmente en el SED-H (11, 97). Este autor también detectó la hipotonía, la debilidad muscular progresiva, el escaso desarrollo de la musculatura y el aleteo escapular, todos ellos sin síntomas de miopatías concomitantes. Se sugirió que la hipotonía muscular podría tener una base en la anormalidad del colágeno en las vainas de los músculos, en lugar de en las fibras musculares en sí mismas, pero se ha estimado que esto es improbable. Por el contrario, estos síntomas se consideraron secundarios a la evitación del ejercicio, debida a la hiperlaxitud e inestabilidad de las articulaciones.
Esto podría haber contribuido al relativo descuido de las características musculares en el SED, y durante años solo unos pocos reportes de caso señalaron estas manifestaciones del SED. Banerjee et al. registraron el caso de un niño de 9 años con retrasos en el comienzo de la caminata y marcha anormal (98). La presencia de hipoplasia muscular marcada con hipotonía llevó a un diagnóstico inicial de enfermedad muscular primaria; luego se encontró que tenía piel hiperextensible y frágil y articulaciones hiperlaxas, y se le diagnosticó SED. El segundo caso fue registrado por Bertin et al., mostrando una combinación de SED y distrofia muscular en un varón de 16 años (99). Además, Palmeri et al. registraron la asociación de dolor muscular crónico y calambres y el SED tipo Vascular (100).
El primer estudio sobre las bases fisiológicas de la debilidad muscular en el SED fue realizado por Bilkey et al., que demostraron que la debilidad muscular se debía principalmente a las alteraciones en el tejido conectivo que rodea las células musculares (101).
En 2009, Voermans et al. realizaron un estudio retrospectivo en 40 pacientes con diagnóstico confirmado genética o bioquímicamente de varias formas de SED (Vascular, Clásico, SED-H y deficiente en tenascina-x), mostrando que la participación neuromuscular de leve a moderada es frecuente en varios tipos de SED (12).
Los pacientes señalaron tener debilidad muscular, mialgias, fatigarse fácilmente y poder caminar distancias limitadas. El examen físico reveló debilidad muscular de leve a moderada, una reducción en el sentido de la vibración y una leve deficiencia en la movilidad y en las actividades diarias. Investigaciones adicionales demostraron solamente signos miopáticos leves específicos. Los hallazgos de este estudio han aumentado la conciencia sobre los síntomas neuromusculares en los pacientes con SED. Las biopsias de músculo para excluir la presencia de una miopatía coexistente podrían no ser necesarias si se encuentran los hallazgos clínicos y neurofisiológicos típicos y el diagnóstico es confirmado por un experto en el campo.
Otro hallazgo en este estudio fue la notoria relación entre los niveles residuales de TNX y el grado de participación neuromuscular, compatible con una relación dosis-efecto. Esto señala el rol de los defectos de la matriz extracelular en el músculo y en la disfunción nerviosa periférica en el SED (12). Esto se confirmó en estudios fisiológicos en pacientes con deficiencias en TNXB y en ratones knock-out para TNXB (39). Apoya este hallazgo un caso reciente que registra un paciente con SED deficiente en TNX con debilidad y atrofia muscular axial y proximal progresiva en las extremidades. Este paciente tenía solo una leve hiperextensibilidad en la piel, no tenía anormalidades en las articulaciones, y un antecedente de facilidad para los moretones. La biopsia músculo esquelética mostró una consistencia muscular sorprendente y la presencia anormal de uniones miotendinosas en los músculos del abdomen (102).
Neuropatías
En varios tipos de SED se han registrado neuropatías del plexo braquial y/o lumbosacro y mononeuropatías por compresión (26,103-106). Aunque el estudio de Voermans et al. se centró principalmente en los músculos, también se han observado signos de participación de los nervios periféricos en el SED. Los estudios de conducción nerviosa demostraron polineuropatías axonales en el 13% de los pacientes, principalmente en los tipos de SED Vascular y deficiente en TNXB (12). Recientemente, un estudio sobre las neuropatías por atrapamiento y las polineuropatías en el SED-H demostró una mayor prevalencia de síntomas neuropáticos (parestesias/adormecimiento de manos y/o de pies) que de evidencias neurofisiológicas y por ultrasonido de participación nerviosa focal o difusa. Esto podría deberse a la presencia de radiculopatías o de neuropatías en las fibras pequeñas, algo que no fue evaluado en este estudio. Además, se detectó una elevada prevalencia de subluxación/luxación del nervio ulnar en el codo, mediante estudios de ultrasonido dinámicos (107).
El mecanismo patofisiológico de las neuropatías periféricas en el SED-H parece relacionarse con las dislocaciones y subluxaciones, debidas a la laxitud ligamentaria y capsular, que produce un estiramiento anormal o una presión en los nervios periféricos, y da como resultado una neuropatía o plexopatía. También podría estar involucrado un aumento de la vulnerabilidad de los nervios periféricos al estiramiento o a la presión, relacionado directamente con el defecto genético subyacente. El tejido conectivo de los nervios periféricos – el epi, peri o endoneurio deficiente en TNXB o en los colágenos I, III o V, podría no resistir el estrés mecánico excesivo (26).
Características del desarrollo
En el SED es raro el retraso global en el desarrollo que evolucione hacia la discapacidad intelectual. Dada la elevada frecuencia de laxitud articular en la población general, así como en enfermedades genéticas incapacitantes, la presencia de un retraso global en el desarrollo debería orientar al médico hacia la búsqueda de diagnósticos diferentes al del SED. La posible excepción a esta regla está representada por el fenotipo parecido al del SED asociado con deleciones en el cromosoma 6q27 (108) que puede detectarse mediante la técnica CGH-array, una investigación de primera línea para individuos con características parecidas a las del SED con discapacidad intelectual.
Por el contrario, datos relativamente robustos apoyan una fuerte relación entre la hiperlaxitud articular y una disminución del desempeño motor en niños. De hecho, mientras que los primeros trabajos no detectaron una asociación entre la hiperlaxitud articular y los atributos del desarrollo neurológico (109), dos estudios más recientes demuestran que la hiperlaxitud articular es más común entre los niños con trastornos del desarrollo de la coordinación (110-112).
De manera complementaria, la marcha anormal, la torpeza y la mala coordinación, son hallazgos comunes en niños con un diagnóstico previo de SHA/SED-H (113,114). Esta influencia aparentemente selectiva de la hiperlaxitud articular congénita sobre la coordinación podría ser la consecuencia de una deficiencia en la propiocepción en las fases críticas del desarrollo motor. Esta hipótesis se basa en la evidencia reiterada de defectos propioceptivos en el SHA/SED-H (115-119). La combinación de hiperlaxitud articular generalizada y los atributos motores en los niños con SHA/SED-H mencionados más arriba, explican por qué ellos se desempeñan bien en deportes como la gimnasia artística, el ballet y la danza, y a menudo mejoran su desempeño motor con el ejercicio. La propensión natural a deportes específicos, que contrasta con las escasas habilidades de coordinación registradas por muchos pacientes, es una característica primaria de la “primera fase” en la progresión de la enfermedad recientemente delineada para el SHA/SED-H (14,35,46). Este perfil del neurodesarrollo parece ser extremadamente común en el SHA/SED-H, y presumiblemente también en otras enfermedades hereditarias del tejido conectivo.
Conclusión
Esta revisión de las manifestaciones neurológicas del SED demuestra un conjunto de características del sistema nervioso central y periférico mayormente no reconocido en pacientes con enfermedades hereditarias del tejido conectivo.
La familiaridad que cualquier neurólogo tiene con algunas de estas manifestaciones cuando se registran en la población general, como las enfermedades cerebrovasculares, la jaqueca, la mialgia y la fatiga, coloca a los neurólogos en una posición privilegiada para reconocer rápidamente el SED. Aunque la evaluación de los pacientes con SED es, por definición, multisistémica y a menudo realizada por otros especialistas, como los reumatólogos y los genetistas clínicos, el neurólogo tiene grandes chances de evaluar casos de SED no detectados con presentaciones neurológicas.
Además, mientras que las características patognomónicas del SED no son herencia histórica de la neurología, ahora sabemos que una gran proporción de las elevadas tasas de mortalidad y morbilidad en los pacientes con SED se relaciona con las reverberaciones que tienen el desarreglo primario del tejido conectivo en el desarrollo y funcionamiento del sistema nervioso.
Por lo tanto, todos los médicos ocasional o constantemente involucrados en el tratamiento del SED deberían estar conscientes de las manifestaciones neurológicas de esta enfermedad, tanto desde una perspectiva clínica como de investigación.
Desde un punto de vista práctico, el grupo de tipos de SED es grande, con un amplio abanico de manifestaciones y posibles complicaciones. Sin embargo, en este artículo, que repasa las características neurológicas del SED, la variabilidad en la presentación podría disminuirse a una lista discreta (Tabla 4) (120)
La Figura 3 (120) ilustra los procedimientos para evaluar la hiperlaxitud articular generalizada mediante la escala de Beighton (121) que actualmente está incluida tanto en los Criterios de Villefranche como en los de Brighton, así como la escala alternativa d Bulbena, que ha probado ser igualmente eficiente para discriminar a los individuos hiperlaxos de los no hiperlaxos (122). Ambos conjuntos tienen límites y no son ideales en todas las situaciones, pero podrían considerarse métodos iniciales útiles de evaluación. El puntaje positivo que se ilustra en la Figura 3 debería indicarle al neurólogo la derivación del paciente con un experto en el campo para la confirmación del diagnóstico y el adecuado tratamiento multidisciplinario.
Tabla 4. “Señales de alarma” para sospechar el Síndrome de Ehlers-Danlos
Señales clínicas clave por categoría
|
Antecedentes Generales
|
Retrasos en los hitos del desarrollo motor grueso
|
Trastorno del desarrollo de la coordinación
|
Hiperlaxitud en los deportes; con destreza en el ballet y la gimnasia artística durante la infancia
|
Haber realizado “posiciones extrañas con el cuerpo” (hiperextensiones articulares) durante la infancia
|
Abandono de los deportes durante la adolescencia debido a las lesiones recurrentes, el dolor y la fatiga
|
Debilidad muscular leve generalizada
|
Dolor músculo-esquelético inexplicable
|
Facilidad para fatigarse
|
Parestesias
|
Antecedentes médicos
|
(Sub)Luxaciones recurrentes
|
Rupturas de tendones y músculos
|
Prolapso anal durante la infancia
|
Efecto reducido de la anestesia local
|
Complicaciones con las cirugías
|
Facilidad para la formación de moretones, a veces con la sospecha incorrecta de abuso infantil
|
Cicatrización anormal de las heridas con cicatrices atróficas amplias
|
Prolapso de útero o insuficiencia cervical con parto prematuro
|
Aparición temprana de venas varicosas
|
Pneumotórax o pneumohemotórax
|
Rupturas arteriales espontáneas (mayormente en los tipos de SED Vascular o Cifoescoliosis)
|
Pie equinovaro (principalmente en el SED Vascular)
|
Fragilidad o ruptura intestinal o uterina (principalmente en el SED Vascular)
|
Escoliosis severa al momento del nacimiento (principalmente en el SED Cifoescoliosis)
|
Dislocación bilateral congénita de la cadera (principalmente en el SED Artrocalasia)
|
Antecedentes Familiares
|
Hiperlaxitud generalizada/contorsionismo
|
Muerte súbita (SED Vascular)
|
Examen físico
|
Hiperlaxitud generalizada (puntaje de 5 o más puntos en la Escala de Beighton)
|
Hiperextensibilidad de la piel (≥ 3 cm en la cara volar del antebrazo)
|
Piel suave, aterciopelada
|
Cicatrices amplias, atróficas
|
Pseudotumores moluscoides
|
Esferoides subcutáneos
|
Piel fina, translúcida, apariencia facial característica, y acrogeria (SED Vascular)
|
Retracción gingival/(aparición temprana de) parodontopatía
|
Microcórnea (SED tipo Cifoescoliosis)
|
Cifoescoliosis congénita (SED tipo Cifoescoliosis o Artrocalasia)
|
Examen neurológico
|
Debilidad proximal leve (MRC 4)
|
Reducción leve del sentido de vibración (medida con diapasón de Rydel-Seiffer)
|
Reducción sin ausencia de reflejos tendinosos
|
Investigaciones secundarias
|
Estudios de conducción nerviosa: reducción del potencial de acción muscular compuesto(PAMC) en los músculos distales, polineuropatías axonales sensoriomotoras leves
|
Electromiografía: patron mixto, tanto de unidades pequeñas (miopáticas) como grandes (neurogénicas), o predominantemente de unidades miopáticas
|
Creatinkinasa (CK) normal o levemente aumentada (generalmente < 500)
|
Bisopsia de músculo: características normales o levemente miopáticas (aumento en la varianza del diámetro de las fibras y de los núcleos internos)
|
Estudios por imágenes del corazón: prolapso de válvula mitral, o dilatación aórtica proximal no progresiva
|
Densitometría ósea con aparición temprana de osteopenia
|
Figura 3. Resumen de los puntajes de Beighton y Bulbena para evaluar la hiperlaxitud articular
Escala de Beighton:
Grado de movilidad mediante maniobras pasivas en 5 articulaciones.
Puntaje total: 0-9
Hiperlaxitud: Puntaje ≥5
General:
1) Dorsiflexión de los meñiques más allá de los 90º. Un punto por cada mano
2) Aposición de los pulgares a la cara flexora del antebrazo. Un punto por cada mano
3) Hiperextensión de los codos de más de más de 10º. Un punto por cada codo.
4) Hiperextensión de las rodillas de más de 10º. Un punto por cada rodilla.
5) Flexión del tronco hacia adelante con las rodillas completamente extendidas, de manera tal que las palmas de las manos toquen planas el piso. Un punto.
Escala de Bulbena:
Grado de movilidad mediante maniobras pasivas en 9 articulaciones
Puntaje total: 0-10.
Hiperlaxitud: Puntaje ≥5 (mujeres) y Puntaje ≥4 (hombres)
Extremidades superiores:
1) Pulgar: aposición pasiva del pulgar a la cara flexora del antebrazo <21 mm.
2) Meacarpofalange: con la palma de la mano descansando sobre una mesa, la dorsiflexión pasiva del meñique es ≥90º
3) Hiperextensión del codo: hiperextensión pasiva del codo ≥10º
4) Rotación externa del hombro: con la parte superior del brazo tocando el cuerpo, y el codo fijado a 90º, el antebrazo se rota externamente >85º en el plano sagital (sobre la línea del hombro).
Extremidades inferiores-Posición decúbito dorsal:
5) Abducción de la cadera: abducción pasiva de la cadera ≥85º
6) Hipermovilidad de la rótula: sosteniendo con une mano el extremo proximal de la tibia, la rótula puede moverse bien hacia los lados con la otra mano
7) Hiperlaxitud de los tobillos y pies: se puede producir un rango excesivo de dorsiflexión pasiva o eversión del pie
8) Metatarsofalange: flexión dorsal del pulgar sobre la diáfisis del primer metatarsiano ≥90º
Extemidades inferiores-Posición decúbito ventral:
9) Hiperflexión e la rodilla: La flexión de la rodilla permite que el talón toque contacto con las nalgas.
General:
Presencia o ausencia de equimosis (1 punto por la presencia de equimosis)
Un punto por cada articulación hiperlaxa
Referencias
1. Ehlers E, Cutis L. Neigung zu Haemorhagien in der Haut, Lockerung mehrerer Artikulationen. Dermatologische Zeitschrift 1901; 8: 173-4.
2. Danlos HA. Un cas de cutis laxa avec tumeurs par contusion chronique des coudes et des genoux (xanthome juvenile pseudodiabétique de MM, Halloepau et Macé de Lépinay). Bulletin de la Société Française de Dermatologie et de Syphiligraphie 1908; 39: 1252-56.
3. Beighton P, De Paepe A, Steinmann B, Tsipouras P, Wenstrup RJ. Ehlers-Danlos syndromes: revised nosology, Villefranche, 1997. Ehlers-Danlos National Foundation (USA) and Ehlers-Danlos Support Group (UK). Am J Med Genet 1998; 77(1): 31-7.
4. Mayer K, Kennerknecht I, Steinmann B. Clinical utility gene card for: Ehlers-Danlos syndrome types I-VII and variants – update 2012. Eur J Hum Genet 2013; 21(1).
5. Grahame R, Bird HA, Child A. The revised (Brighton 1998) criteria for the diagnosis of benign joint hypermobility syndrome (BJHS). J Rheumatol 2000; 27(7): 1777-9.
6. Tinkle BT, Bird HA, Grahame R, Lavallee M, Levy HP, Sillence D. The lack of clinical distinction between the hypermobility type of Ehlers-Danlos syndrome and the joint hypermobility syndrome (a.k.a. hypermobility syndrome). Am J Med Genet A 2009; 149A(11): 2368-70.
7. Castori M, Morlino S, Grammatico P. Towards a re-thinking of the clinical significance of generalized joint hypermobility, joint hypermobility syndrome, and Ehlers-Danlos syndrome, hypermobility type. Am J Med Genet A 2014; 164A(3): 588-90.
8. De Paepe A, Malfait F. The Ehlers- Danlos syndrome, a disorder with many faces. Clin Genet 2012; 82(1): 1-11.
9. Steinmann B, Royce PM, Superti-Furga A. The Ehlers-Danlos syndrome. In: Royce PM, Steinmann B, editors. Connective Tissue and Its Heritable Disorders: Molecular, Genetic, and Medical Aspects. 2nd ed. New York, NY: John Wiley & Sons; 2003. p. 431-524.
10. Hakim AJ, Sahota A. Joint hypermobility and skin elasticity: the hereditary disorders of connective tissue. Clin Dermatol 2006; 24(6): 521-33.
11. Beighton P, Horan F. Orthopaedic aspects of the Ehlers-Danlos syndrome. J Bone Joint Surg Br 1969; 51(3): 444-53.
12. Voermans NC, van Alfen N, Pillen S, Lammens M, Schalkwijk J, Zwarts MJ, et al. Neuromuscular involvement in various types of Ehlers-Danlos syndrome. Ann Neurol 2009; 65(6): 687-97.
13. Savasta S, Merli P, Ruggieri M, Bianchi L, Sparta MV. Ehlers-Danlos syndrome and neurological features: a review. Childs Nerv Syst 2011; 27(3): 365-71.
14. Castori M, Morlino S, Celletti C, Ghibellini G, Bruschini M, Grammatico P, et al. Re-writing the natural history of pain and related symptoms in the joint hypermobility syndrome/Ehlers-Danlos syndrome, hypermobility type. Am J Med Genet A 2013; 161A(12): 2989-3004.
15. Schmalzried TP, Eckardt JJ. Spontaneous gluteal artery rupture resulting in compartment syndrome and sciatic neuropathy. Report of a case in Ehlers-Danlos syndrome. Clin Orthop Relat Res 1992; (275): 253-7.
16. Harris SC, Slater DN, Austin CA. Fatal splenic rupture in Ehlers-Danlos syndrome. Postgrad Med J 1985; 61(713): 259-60.
17. Kahana M, Levy A, Ronnen M, Cohen M, Schewach-Millet M. Painful piezogenic pedal papules on a child with Ehlers-Danlos syndrome. Pediatr Dermatol 1985; 3(1): 45-7.
18. Sakala EP, Harding MD. Ehlers-Danlos syndrome type III and pregnancy. A case report. J Reprod Med 1991; 36(8): 622-4.
19. Lumley MA, Jordan M, Rubenstein R, Tsipouras P, Evans MI. Psychosocial functioning in the Ehlers-Danlos syndrome. Am J Med Genet 1994; 53(2): 149-52.
20. Arendt-Nielsen L, Kaalund S, Bjerring P, Hogsaa B. Insufficient effect of local analgesics in Ehlers Danlos type III patients (connective tissue disorder). Acta Anaesthesiol Scand 1990; 34(5): 358-61.
21. Hakim AJ, Grahame R, Norris P, Hopper C. Local anaesthetic failure in joint hypermobility syndrome. J R Soc Med 2005; 98(2): 84-5.
22. Voermans NC, Knoop H, Bleijenberg G, van Engelen BG. Pain in ehlers-danlos syndrome is common, severe, and associated with functional impairment. J Pain Symptom Manage 2010; 40(3): 370-8.
23. Voermans NC, Knoop H. Both pain and fatigue are important possible determinants of disability in patients with the Ehlers-Danlos syndrome hypermobility type. Disabil Rehabil 2011; 33(8): 706-7.
24. Ofluoglu D, Gunduz OH, Kul-Panza E, Guven Z. Hypermobility in women with fibromyalgia syndrome. Clin Rheumatol 2006; 25(3): 291-3.
25. Sendur OF, Gurer G, Bozbas GT. The frequency of hypermobility and its relationship with clinical findings of fibromyalgia patients. Clin Rheumatol 2007; 26(4): 485-7.
26. Voermans NC, Drost G, van Kampen A, Gabreels-Festen AA, Lammens M, Hamel BC, et al. Recurrent neuropathy associated with Ehlers-Danlos syndrome. J Neurol 2006; 253(5): 670-1.
27. Voermans NC, Knoop H, van Engelen BG. High frequency of neuropathic pain in Ehlers-Danlos syndrome: an association with axonal polyneuropathy and compression neuropathy? J Pain Symptom Manage 2011; 41(5): e4-e6.
28. Fikree A, Aziz Q, Grahame R. Joint hypermobility syndrome. Rheum Dis Clin North Am 2013; 39(2): 419-30.
29. McIntosh LJ, Mallett VT, Frahm JD, Richardson DA, Evans MI. Gynecologic disorders in women with Ehlers-Danlos syndrome. J Soc Gynecol Investig 1995; 2(3): 559-64.
30. Castori M, Morlino S, Dordoni C, Celletti C, Camerota F, Ritelli M, et al. Gynecologic and obstetric implications of the joint hypermobility syndrome (a.k.a. Ehlers-Danlos syndrome hypermobility type) in 82 Italian patients. Am J Med Genet A 2012; 158A(9): 2176-82.
31. Sacheti A, Szemere J, Bernstein B, Tafas T, Schechter N, Tsipouras P. Chronic pain is a manifestation of the Ehlers-Danlos syndrome. J Pain Symptom Manage 1997; 14(2): 88-93.
32. Rombaut L, Scheper M, De Wandele I, De Vries J, Meeus M, Malfait F, et al. Chronic pain in patients with the hypermobility type of Ehlers-Danlos syndrome: evidence for generalized hyperalgesia. Clin Rheumatol 2014.
33. Voermans NC, Knoop H, van de Kamp N, Hamel BC, Bleijenberg G, van Engelen BG. Fatigue is a frequent and clinically relevant problem in Ehlers-Danlos Syndrome. Semin Arthritis Rheum 2010; 40(3): 267-74.
34. Rombaut L, Malfait F, Cools A, De Paepe A, Calders P. Musculoskeletal complaints, physical activity and health-related quality of life among patients with the Ehlers-Danlos syndrome hypermobility type. Disabil Rehabil 2010; 32(16): 1339-45.
35. Castori M, Sperduti I, Celletti C, Camerota F, Grammatico P. Symptom and joint mobility progression in the joint hypermobility syndrome (Ehlers-Danlos syndrome, hypermobility type). Clin Exp Rheumatol 2011; 29(6): 998-1005.
36. Fukuda K, Straus SE, Hickie I, Sharpe MC, Dobbins JG, Komaroff A. The chronic fatigue syndrome: a comprehensive approach to its definition and study. International Chronic Fatigue Syndrome Study Group. Ann Intern Med 1994; 121(12): 953-9.
37. Castori M, Celletti C, Camerota F, Grammatico P. Chronic fatigue syndrome is commonly diagnosed in patients with Ehlers-Danlos syndrome hypermobility type/joint hypermobility syndrome. Clin Exp Rheumatol 2011; 29(3): 597-8.
38. Voermans NC, Knoop H, Bleijenberg G, van Engelen BG. Fatigue is associated with muscle weakness in Ehlers-Danlos syndrome: an explorative study. Physiotherapy 2011; 97(2): 170-4.
39. Gerrits KH, Voermans NC, de Haan A, van Engelen BG. Neuromuscular properties of the thigh muscles in patients with Ehlers-Danlos syndrome. Muscle Nerve 2013; 47(1): 96-104.
40. Rombaut L, Malfait F, De Wandele I, Taes Y, Thijs Y, De Paepe A, et al. Muscle mass, muscle strength, functional performance, and physical impairment in women with the hypermobility type of Ehlers-Danlos syndrome. Arthritis Care Res (Hoboken) 2012; 64(10): 1584-92.
41. Celletti C, Galli M, Cimolin V, Castori M, Albertini G, Camerota F. Relationship between fatigue and gait abnormality in joint hypermobility syndrome/Ehlers-Danlos syndrome hypermobility type. Res Dev Disabil 2012; 33(6): 1914-8.
42. Mathias CJ, Low DA, Iodice V, Owens AP, Kirbis M, Grahame R. Postural tachycardia syndrome--current experience and concepts. Nat Rev Neurol 2012; 8(1): 22-34.
43. De Wandele I, Rombaut L, Leybaert L, van de Borne P, de Backer T, Malfait F, et al. Dysautonomia and its underlying mechanisms in the hypermobility type of Ehlers-Danlos syndrome. Semin Arthritis Rheum 2014; 44(1): 93-100.
44. Spranger S, Spranger M, Kirchhof K, Steinmann B. Ehlers-Danlos syndrome type VIII and leukodystrophy. Am J Med Genet 1996; 66(2): 239-40.
45. Jacome DE. Headache in Ehlers-Danlos syndrome. Cephalalgia 1999; 19(9): 791-6.
46. Castori M, Camerota F, Celletti C, Danese C, Santilli V, Saraceni VM, et al. Natural history and manifestations of the hypermobility type Ehlers-Danlos syndrome: a pilot study on 21 patients. Am J Med Genet A 2010; 152A(3): 556-64.
47. Bendik EM, Tinkle BT, Al-shuik E, Levin L, Martin A, Thaler R, et al. Joint hypermobility syndrome: A common clinical disorder associated with migraine in women. Cephalalgia 2011; 31(5): 603-13.
48. Kurian M, Solomon GD. Can elevated IGF-1 levels among patients with Ehlers-Danlos syndrome cause idiopathic intracranial hypertension? Headache 2013; 53(10): 1666-9.
49. de Coster PJ, van den Berghe LI, Martens LC. Generalized joint hypermobility and temporomandibular disorders: inherited connective tissue disease as a model with
maximum expression. J Orofac Pain 2005; 19(1): 47-57.
50. Chuman H, Trobe JD, Petty EM, Schwarze U, Pepin M, Byers PH, et al. Spontaneous direct carotid-cavernous fistula in Ehlers-Danlos syndrome type IV: two case reports and a review of the literature. J Neuroophthalmol 2002; 22(2): 75-81.
51. Tanaka T, Hayakawa M, Sadato A, Adachi K, Watabe T, Maeda S, et al. Transvenous embolization for carotid-cavernous fistula in a patient with vascular type of Ehlers-Danlos syndrome--direct superior ophthalmic vein approach: case report. Neurol Med Chir (Tokyo) 2014; 54(2): 155-60.
52. Rozen TD, Roth JM, Denenberg N. Cervical spine joint hypermobility: a possible predisposing factor for new daily persistent headache. Cephalalgia 2006; 26(10): 1182-5.
53. Schievink WI, Meyer FB, Atkinson JL, Mokri B. Spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension. J Neurosurg 1996; 84(4): 598-605.
54. Schievink WI, Gordon OK, Tourje J. Connective tissue disorders with spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension: a prospective study. Neurosurgery 2004; 54(1): 65-70.
55. Hall T, Briffa K, Hopper D. Clinical evaluation of cervicogenic headache: a clinical perspective. J Man Manip Ther 2008; 16(2): 73-80.
56. Mathers KS, Schneider M, Timko M. Occult hypermobility of the craniocervical junction: a case report and review. J Orthop Sports Phys Ther 2011; 41(6): 444-57.
57. Orrell RW, Marsden CD. The necktongue syndrome. J Neurol Neurosurg Psychiatry 1994; 57(3): 348-52.
58. Sjaastad O, Bakketeig LS. Neck-tongue syndrome and related (?) conditions. Cephalalgia 2006; 26(3): 233-40.
59. Gonzalez de la Aleja Tejera, Porta-Etessam J. Neck-tongue syndrome. Possible joint hypermobility as an aetiopathogenic process. An Pediatr (Barc) 2008; 69(5): 484-5. [In Spanish].
60. Di PF, Cronin AH. Ehlers-Danlos syndrome: correlation with headache disorders in a young woman. J Headache Pain 2005; 6(6): 474-5.
61. Schievink WI, Limburg M, Oorthuys JW, Fleury P, Pope FM. Cerebrovascular disease in Ehlers-Danlos syndrome type IV. Accidente cerebrovascular 1990; 21(4): 626-32.
62. Schievink WI, Piepgras DG, Earnest F, Gordon H. Spontaneous carotid-cavernous fistulae in Ehlers-Danlos syndrome Type IV. Case report. J Neurosurg 1991; 74(6): 991-8.
63. North KN, Whiteman DA, Pepin MG, Byers PH. Cerebrovascular complications in Ehlers-Danlos syndrome type IV. Ann Neurol 1995; 38(6): 960-4.
64. Schoolman A, Kepes JJ. Bilateral spontaneous carotid-cavernous fistulae in Ehlers-Danlos syndrome. Case report. J Neurosurg 1967; 26(1): 82-6.
65. Mirza FH, Smith PL, Lim WN. Multiple aneurysms in a patient with Ehlers-Danlos syndrome: angiography without sequelae. AJR Am J Roentgenol 1979; 132(6): 993-5.
66. Gdynia HJ, Kuhnlein P, Ludolph AC, Huber R. Connective tissue disorders in dissections of the carotid or vertebral arteries. J Clin Neurosci 2008; 15(5): 489-94.
67. Dohle C, Baehring JM. Multiple accidente cerebrovasculars and bilateral carotid dissections: a fulminant case of newly diagnosed Ehlers-Danlos syndrome type IV. J Neurol Sci 2012; 318(1-2): 168-70.
68. Ellis RJ, Salehin M, Zhou R, Somauroo M. Type IV Ehlers-Danlos syndrome presenting as recurrent, bilateral carotid dissections. BMJ Case Rep 2012; 2012.
69. Linfante I, Lin E, Knott E, Katzen B, Dabus G. Endovascular repair of direct carotid-cavernous fistula in Ehlers-Danlos type IV. J Neurointerv Surg 2014.
70. Ballabio E, Bersano A, Bresolin N, Candelise L. Monogenic vessel diseases related to ischemic accidente cerebrovascular: a clinical approach. J Cereb Blood Flow Metab 2007; 27(10): 1649-62.
71. Vanakker OM, Hemelsoet D, de Paepe A. Hereditary connective tissue diseases in young adult accidente cerebrovascular: a comprehensive synthesis. Accidente cerebrovascular Res Treat 2011; 2011: 712903.
72. Bersano A, Borellini L, Motto C, Lanfranconi S, Pezzini A, Basilico P, et al. Molecular basis of young ischemic accidente cerebrovascular. Curr Med Chem 2013; 20(31): 3818-39.
73. Lum YW, Brooke BS, Black JH. Contemporary management of vascular Ehlers-Danlos syndrome. Curr Opin Cardiol 2011; 26(6): 494-501.
74. Ong KT, Perdu J, de Backer J, Bozec E, Collignon P, Emmerich J, et al. Effect of celiprolol on prevention of cardiovascular events in vascular Ehlers-Danlos syndrome: a prospective randomised, open, blindedendpoints trial. Lancet 2010; 376(9751): 1476-84.
75. Germain DP. Ehlers-Danlos syndrome type IV. Orphanet J Rare Dis 2007; 2: 32. 76. Thomas P, Bossan A, Lacour JP, Chanalet S, Ortonne JP, Chatel M. Ehlers-Danlos syndrome with subependymal periventricular heterotopias. Neurology 1996; 46(4): 1165-7.
77. Sheen VL, Jansen A, Chen MH, Parrini E, Morgan T, Ravenscroft R, et al. Filamin A mutations cause periventricular heterotopia with Ehlers-Danlos syndrome. Neurology 2005; 64(2): 254-62.
78. Echaniz-Laguna A, de Saint-Martin A, Lafontaine AL, Tasch E, Thomas P, Hirsh E, et al. Bilateral focal polymicrogyria in Ehlers-Danlos syndrome. Arch Neurol 2000; 57(1): 123-7.
79. Dotti MT, de Stefano N, Mondillo S, Agricola E, Federico A. Neurological involvement and quadricuspid aortic valve in a patient with Ehlers-Danlos syndrome. J Neurol 1999; 246(7): 612-3.
80. Hagino H, Eda I, Takashima S, Takeshita K, Sugitani A. Computed tomography in patients with Ehlers-Danlos syndrome. Neuroradiology 1985; 27(5): 443-5.
81. Pretorius ME, Butler IJ. Neurologic manifestations of Ehlers-Danlos syndrome. Neurology 1983; 33(8): 1087-9.
82. Brunk I, Stover B, Ikonomidou C, Brinckmann J, Neumann LM. Ehlers-Danlos syndrome type VI with cystic malformations of the meninges in a 7-year-old girl. Eur J Pediatr 2004; 163(4-5): 214-7.
83. Grosveld WJ, Gilhuis HJ, Voermans NC. Spontaneous intracranial hypotension in a patient with classical type Ehlers-Danlos syndrome. Neurol India 2011; 59(4): 633-4.
84. Castori M, Morlino S, Celletti C, Celli M, Morrone A, Colombi M, et al. Management of pain and fatigue in the joint hypermobility syndrome (a.k.a. Ehlers-Danlos syndrome, hypermobility type): principles and proposal for a multidisciplinary approach. Am J Med Genet A 2012; 158A(8): 2055-70.
85. Isono M, Hori S, Konishi Y, Kinjo H, Kakisako K, Hirose R, et al. Ehlers-Danlos syndrome associated with multiple spinal meningeal cysts--case report. Neurol Med Chir (Tokyo) 1999; 39(5): 380-3.
86. Castori M, Morlino S, Ritelli M, Brancati F, de Bernardo C, Colombi M, et al. Late diagnosis of lateral meningocele syndrome in a 55-year-old woman with symptoms of joint instability and chronic musculoskeletal pain. Am J Med Genet A 2014; 164A(2): 528-34.
87. Chen KM, Bird L, Barnes P, Barth R, Hudgins L. Lateral meningocele syndrome: vertical transmission and expansion of the phenotype. Am J Med Genet A 2005; 133A(2): 115-21.
88. Schievink WI. Spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension. JAMA 2006; 295(19): 2286-96.
89. Reinstein E, Pariani M, Bannykh S, Rimoin DL, Schievink WI. Connective tissue spectrum abnormalities associated with spontaneous cerebrospinal fluid leaks: a prospective study. Eur J Hum Genet 2013; 21(4): 386-90.
90. Milhorat TH, Bolognese PA, Nishikawa M, McDonnell NB, Francomano CA. Syndrome of occipitoatlantoaxial hypermobility, cranial settling, and chiari malformation type I in patients with hereditary disorders of connective tissue. J Neurosurg Spine 2007; 7(6): 601-9.
91. Halko GJ, Cobb R, Abeles M. Patients with type IV Ehlers-Danlos syndrome may be predisposed to atlantoaxial subluxation. J Rheumatol 1995; 22(11): 2152-5.
92. Cupo LN, Pyeritz RE, Olson JL, McPhee SJ, Hutchins GM, McKusick VA. Ehlers-Danlos syndrome with abnormal collagen fibrils, sinus of Valsalva aneurysms, myocardial infarction, panacinar emphysema and cerebral heterotopias. Am J Med 1981; 71(6): 1051-8.
93. Gomez-Garre P, Seijo M, Gutierrez- Delicado E, Castro del RM, de la Torre C, Gomez-Abad C, et al. Ehlers-Danlos syndrome and periventricular nodular heterotopia in a Spanish family with a single FLNA mutation. J Med Genet 2006; 43(3): 232-7.
94. Jacome DE. Epilepsy in Ehlers-Danlos syndrome. Epilepsia 1999; 40(4): 467-73.
95. Voermans NC, Bonnemann CG, Hamel BC, Jungbluth H, van Engelen BG. Joint hypermobility as a distinctive feature in the differential diagnosis of myopathies. J Neurol 2009; 256(1): 13-27.
96. Voermans NC, Bönnemann CG, Huijing PA, Hamel BC, van Kuppevelt TH, de Haan A et al. Clinical and molecular overlap between myopathies and inherited connective tissue diseases. Neuromuscul Disord 2008; 18(11): 843-56.
97. Beighton P, Price A, Lord J, Dickson E. Variants of the Ehlers-Danlos syndrome. Clinical, biochemical, haematological, and chromosomal features of 100 patients. Ann Rheum Dis 1969; 28(3): 228-45.
98. Banerjee G, Agarwal RK, Shembesh NM, el Mauhoub M. syndrome--masquerading as primary muscle disease. Postgrad Med J 1988; 64(748): 126-7.
99. Bertin P, Treves R, Julia A, Gaillard S, Desproges-Gotteron R. Ehlers-Danlos syndrome, clotting disorders and muscular dystrophy. Ann Rheum Dis 1989; 48(11): 953-6.
100. Palmeri S, Mari F, Meloni I, Malandrini A, Ariani F, Villanova M, et al. Neurological presentation of Ehlers-Danlos syndrome type IV in a family with parental mosaicism. Clin Genet 2003; 63(6): 510-5.
101. Bilkey WJ, Baxter TL, Kottke FJ, Mundale MO. Muscle formation in Ehlers-Danlos syndrome. Arch Phys Med Rehabil 1981; 62(9): 444-8.
102. Penisson-Besnier I, Allamand V, Beurrier P, Martin L, Schalkwijk J, van Vlijmen- Willems I, et al. Compound heterozygous mutations of the TNXB gene cause primary myopathy. Neuromuscul Disord 2013; 23(8): 664-9.
103. de Graaf AS. Neuralgic amyotrophy in identical twins with Ehlers-Danlos syndrome. Eur Neurol 1973; 9(3): 190-6.
104. Kayed K, Kass B. Acute multiple brachial neuropathy and Ehlers-Danlos syndrome. Neurology 1979; 29(12): 1620-1.
105. el-Shaker M, Watts HG. Acute brachial plexus neuropathy secondary to halo-gravity traction in a patient with Ehlers-Danlos syndrome. Spine (Phila Pa 1976) 1991; 16(3): 385-6.
106. Galan E, Kousseff BG. Peripheral neuropathy in Ehlers-Danlos syndrome. Pediatr Neurol 1995; 12(3): 242-5.
107. Granata G, Padua L, Celletti C, Castori M, Saraceni VM, Camerota F. Entrapment neuropathies and polyneuropathies in joint hypermobility syndrome/Ehlers-Danlos syndrome. Clin Neurophysiol 2013; 124(8): 1689-94.
108. Mosca AL, Callier P, Masurel-Paulet A, Thauvin-Robinet C, Marle N, Nouchy M, et al. Cytogenetic and array-CGH characterization of a 6q27 deletion in a patient with developmental delay and features of Ehlers-Danlos syndrome. Am J Med Genet A 2010; 152A(5): 1314-7.
109. Davidovitch M, Tirosh E, Tal Y. The relationship between joint hypermobility and neurodevelopmental attributes in elementary school children. J Child Neurol 1994; 9(4): 417-9.
110. Kirby A, Davies R. Developmental Coordination Disorder and Joint Hypermobility Syndrome—overlapping disorders? Implications for research and clinical practice. Child Care Health Dev 2007; 33(5): 513-9.
111. Jelsma LD, Geuze RH, Klerks MH, Niemeijer AS, Smits-Engelsman BC. The relationship between joint mobility and motor performance in children with and without the diagnosis of developmental coordination disorder. BMC Pediatr 2013; 13: 35.
112. Morrison SC, Ferrari J, Smillie S. Assessment of gait characteristics and orthotic management in children with Developmental Coordination Disorder: preliminary findings to inform multidisciplinary care. Res Dev Disabil 2013; 34(10): 3197-201.
113. Adib N, Davies K, Grahame R, Woo P, Murray KJ. Joint hypermobility syndrome in childhood. A not so benign multisystem disorder? Rheumatology (Oxford) 2005; 44(6): 744-50.
114. Easton V, Bale P, Bacon H, Jerman E, Armon K, Macgregor AJ. A89: the relationship between benign joint hypermobility syndrome and developmental coordination disorders in children. Arthritis Rheumatol 2014; 66(Suppl 11): S124.
115. Mallik AK, Ferrell WR, McDonald AG, Sturrock RD. Impaired proprioceptive acuity at the proximal interphalangeal joint in patients with the hypermobility syndrome. Br J Rheumatol 1994; 33(7): 631-7.
116. Hall MG, Ferrell WR, Sturrock RD, Hamblen DL, Baxendale RH. The effect of the hypermobility syndrome on knee joint proprioception. Br J Rheumatol 1995; 34(2): 121-5.
117. Fatoye F, Palmer S, Macmillan F, Rowe P, van der Linden M. Proprioception and muscle torque deficits in children with hypermobility syndrome. Rheumatology (Oxford) 2009; 48(2): 152-7.
118. Rombaut L, de Paepe A, Malfait F, Cools A, Calders P. Joint position sense and vibratory perception sense in patients with Ehlers-Danlos syndrome type III (hypermobility type). Clin Rheumatol 2010; 29(3): 289-95.
119. Celletti C, Castori M, Galli M, Rigoldi C, Grammatico P, Albertini G, et al. Evaluation of balance and improvement of proprioception by repetitive muscle vibration in a 15-year-old girl with joint hypermobility syndrome. Arthritis Care Res (Hoboken) 2011; 63(5): 775-9.
120. Voermans NC. Neuromuscular features of Ehlers-Danlos syndrome and Marfan syndrome expanding the phenotype of inherited connective tissue disorders and investigating the role of the extracellular matrix in muscle the connective tissue of peripheral nerves [Online]. [cited 2011]; Available from: URL: dare.ubn.ru.nl/bitstream/2066/91217/1/91217.pdf.
121. Beighton P, Solomon L, Soskolne CL. Articular mobility in an African population. Ann Rheum Dis 1973; 32(5): 413-8. 122. Bulbena A, Duro JC, Porta M, Faus S, Vallescar R, Martin-Santos R. Clinical assessment of hypermobility of joints: assembling criteria. J Rheumatol 1992; 19(1): 115-22.


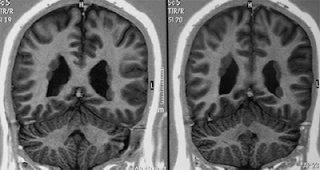




No hay comentarios.:
Publicar un comentario
Este es un espacio abierto a la discusión, a compartir información, experiencias de vida y opiniones, pero no es un tablón de anuncios. Por esta razón, en los comentarios del blog no promociones productos (de cualquier índole), ni recomendaciones de tratamientos, ni empresas (del rubro que sea), ya que serán prestamente marcados como spam y borrados.
** No olvides escribir tu nombre en tu comentario! No publico comentarios anónimos **
Gracias!
Ale Guasp